Distribuição eletrônica - Química - aula do dia 15/07- Turmas 2° anos
Atividade de Química para todos os Segundos Anos
Professores:
Evaldo (2 C e 2 D)
Natalino ( 2 A e 2 B)
Após terem surgido vários modelos atômicos, o modelo de Bohr sugeriu a organização da eletrosfera em órbitas.
Os elétrons se organizam e distribuem-se pelas camadas eletrônicas, estando uns mais próximos do núcleo e outros mais distantes.
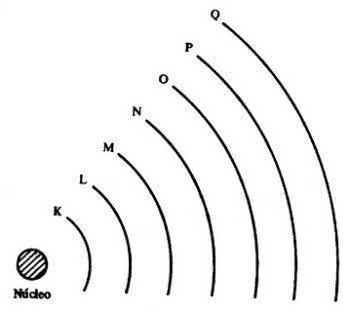
Então, surgiram as 7 camadas eletrônicas (K, L, M, N, O, P e Q), as quais são representadas pelas linhas horizontais numeradas de 1 a 7 na tabela periódica.
Os elementos que constam nas mesmas linhas apresentam o mesmo número máximo de elétrons e também os mesmos níveis de energia.
Com isso, é possível observar que os elétrons encontram-se em níveis e sub-níveis de energia. Assim, cada um possui uma determinada quantidade de energia.
| Nível de Energia | Camada Eletrônica | Nº Máximo de Elétrons |
|---|---|---|
| 1° | K | 2 |
| 2° | L | 8 |
| 3° | M | 18 |
| 4° | N | 32 |
| 5° | O | 32 |
| 6° | P | 18 |
| 7° | Q | 8 |
A camada de valência é a última camada eletrônica, ou seja, a camada mais externa do átomo. Segundo a Regra do Octeto, os átomos possuem a tendência de se estabilizarem e ficarem neutros.
Isso acontece quando eles apresentam a mesma quantidade de prótons e nêutrons, com oito elétrons na última camada eletrônica.
Exemplo de distribuição eletrônica:
A distribuição eletrônica do elemento Ferro (Fe) que apresenta número atômico 26 (Z = 26):
Se a distribuição eletrônica for indicada por camadas representa-se da seguinte maneira:
K = 2; L = 8; M = 14; N = 2.
Exercícios
Fazer a atividade 4 E da apostila do segundo bimestre, preencher na própria apostila.
Enviem as atividades a seus professores por whatsapp no privado
Comentários
Postar um comentário